研究者紹介

プロフィール Profile

川村 隆三Ryuzo Kawamura
現 理工学研究科 助教(物質科学部門・物質機能領域)
卓越研究員事業
研究分野
生物物理化学、高分子科学、材料科学 [Biophysical chemistry, Polymer science, Material science]
着任日等
平成26年 4 月1日 着任
平成29年10月1日 卓越研究員
令和04年10月1日 テニュア付与
キーワード
モータータンパク質、細胞骨格、ゲル、自己組織化
[motor protein, cytoskeleton, gel, self-assembly]
経歴
学位・資格等Degree
- 2008年12月
- 博士(理学)(北海道大学)「キネシンによる微小管の動的自己組織化に関する研究」
職歴Work History
- 2008年10月-2008年12月
- 理化学研究所基幹研究所分子情報生命科学特別研究ユニット リサーチアソシエイト
- 2009年1月-2012年3月
- 理化学研究所基幹研究所分子情報生命科学特別研究ユニット 特別研究員
- 2012年4月-2014年3月
- 産業技術総合研究所バイオメディカル研究部門セルメカニクス研究グループ 特別研究員
- 2014年4月-2017年9月
- 埼玉大学大学院理工学研究科 助教
- 2017年10月-
- 現職
受賞Academic Awards
- 2016
- Outstanding Reviewer for Integrative Biology in 2016. (Royal Society of Chemistry)
研究の内容(概要)
生物の運動は、バクテリアからクジラまで実に様々な「大きさ」があります。これは、モータータンパク質という分子が原動力となっています。各々の分子に注目すると、アデノシン三リン酸(ATP)をエネルギー源としてこれを加水分解しながら、ナノメートルの小さな変形を生み出すだけです。しかし、生体内では無数の分子が階層的な構造の中にあって、協同的に作用することで様々な大きさの運動を実現しています。本研究室では、このモータータンパク質分子を使って生物のような運動機能を発揮する材料を創りたいと考えています。どうすれば動く分子の集団的なふるまいを誘導できるか?あれこれ考えながら創ることでその性質を理解しようとしています。
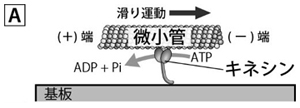
キネシンはモータータンパク質の代表例で、微小管と呼ばれるレールタンパク質の上を歩くように動きます。人工的にキネシン・微小管の動きを観察するには、キネシンを基板に固定して微小管を滑らせて観察する方法があります(図A)。この方法は、キネシンに限らず他のモータータンパク質の働きを解明するのに便利で、現在では一分子の計測すら可能になっています。分子一つまで細かく観察する技術が発達する一方で、多数の分子が集団となったときに独特なふるまいは起きないのだろうか?と当研究室では疑問を持ちました。
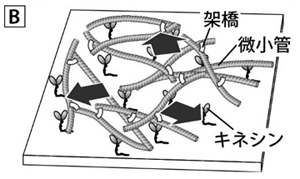
そこで、初歩的な試みとして、キネシンの上で(長軸方向に)滑る微小管同士を糊となる分子で結合(「架橋」と呼ぶ)してみました(図B)。すると、何本もの微小管がネットワークを成し、また一部では束になり、縦に横に揺らぎ運動を発生することがわかりました。
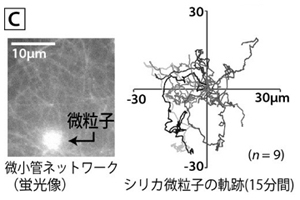
微粒子を載せてみると、揺られて動く(図C)だけでなく、弾けるように速く動く様子が時折観察されます。微小管が架橋されたネットワークは、たくさんのキネシン分子が駆動した仕事を「ひずみ」の弾性エネルギーとして蓄えて、ひずみの弾力がキネシン群の駆動力を越えた時に弾けてパチンコのように微粒子が動く、ということで説明がつきます(RSC Advances 4, 32953–32959, 2014)。現在では、この突発的な動きを思い通りに発生させられれば、マイクロモーターとして使えるのではないかと期待して研究を進めています。 モータータンパク質はまた、ナノメートルの小ささで細胞内のミクロな物質輸送や細胞の変形の原動力ともなっていて、生命の営みにとって大変重要な役割を担っています。例えば、細胞分裂は微小管・キネシンの駆動力が利用されています(「紡錘糸」の糸は、微小管そのものです)。筋肉を構成するモータータンパク質としてよく知られる、ミオシン・アクチンは、細胞の自在な変形や移動の原動力となって、生物の組織構築やがんの転移など、細胞の運動が関わる生命現象に必須の役割を果たしています。そのため、たくさんの細胞が集まってできている生体組織は、モータータンパク質の動きで溢れているはずです。一方、人工的に細胞を培養するとなると、プラスチックのシャーレを使うのが普通で、そこにはそのような動きはありませんでした。さて、図B、Cの微小管ネットワークの揺らぎ利用すれば、シャーレの上でも何か見えるのではないでしょうか?
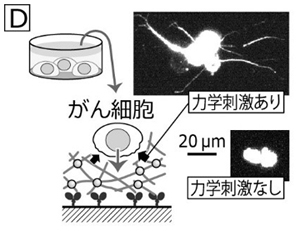
そう考えた当研究室では、図Dのように、キネシンの駆動で揺らぐ微小管ネットワークに、がん細胞を播いてみると、揺らぎのある時だけがん細胞が異常に突起を伸長することを発見しました。このがん細胞の形は、まるで「転移」しようと変形しているかのように見えます(ACS Biomaterials Science & Engineering 2, 2333–2338, 2016)。将来、がん細胞の転移性を予測するツールになるかもしれないと期待して、この研究を進めています。 以上のように、当研究室では生物由来のモータータンパク質という分子の性質を、化学と生物学、そして物理学が融合する領域で新しい研究を展開しようと日々努力しています。